Рассчитайте массу медного купороса, в которой общее число атомов такое, как в карбиде алюминия массой 8,64 г.
Другие вопросы по теме Химия
Популярные вопросы
- Чему равно изменение внутренней энергии, если газу была передана энергия, равная...
3 - Всписке учеников 6-го класса 15 девочек и 13 мальчиков.учитель собирается назначить...
1 - Увисокому, холодноному небі повільно пливуть хмари визначити відмінок прикметників...
1 - 1. выражение: a)3a^2b(-5a^3b) б)(2x^2y)^2 в)(3x-1)(3x+1)+(3x+1)^2 2. разложите...
3 - Примеры слов на -ous -full -y -ing -able -al. 6 класс...
3 - Покажите на примере разных природных зон взаимосвязь природных компонентов...
3 - Разложить на множители : 10ax + 13by - 7 *(x - y) - 10ay - 13bx...
1 - Выберите правильный ответ. целью реформ избранной рады являлось: а) упорядочить...
1 - Іть будь ласка! рівняння координати тіла, кинутого вертикально вгору, має вигляд:...
3 - Какова мощность двигателя подъемника если из шахты глуьиной 400 метров он поднимает...
3
67,24г
Объяснение:
Имеем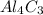 массой 8,64г
массой 8,64г
Количество вещества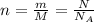 (*),
(*),
из этого соотношения находим число молекул карбида алюминия (N):
Подставляем: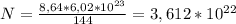 молекул
молекул
В молекуле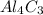 всего 7 атомов, поэтому в
всего 7 атомов, поэтому в 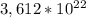 молекулах будет
молекулах будет
Теперь из того же соотношения (*) находим массу CuSO4, в которой общее число атомов равно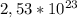 :
: