Рассчитайте формулу соединения, зная, что оно состоит из элемента бария (его массовая доля составляет 58,8 %), водорода (его массовая доля составляет 0,4 %), фосфора (его массовая доля составляет 13,3 %) и элемента кислорода.
Другие вопросы по теме Химия
Популярные вопросы
- Периметр прямоугольника 24см. найдите его площадь...
1 - Всоединении саэо4 массовая доля элемента составляет 33,333%.этот элемент...
3 - Что такое сценический эпизод? определение....
3 - Міркування на тему щастя не у скрині, а в серці . іть, будь-ласка....
2 - Написать краткое сочинение про город сургут на . ! заранее...
2 - Сравните взгляды платона и аристотеля на общество и государство. выделите...
3 - Circle the odd word 1 bookcase, cupboard, table, window. 2 afraid,...
3 - Вводе массой 250г растворили 50г сахара найдите массовую долю в растворе...
2 - Лестница длиной 2,5 м прислоняется к стене, так что наивысшая точка...
2 - Пусть м- множество двузначных натуральных чисел, сумма цифр которых...
3
1) Запишем исходное соединение в виде общей формулы:
2) Найдем массовую долю кислорода:
3) Пусть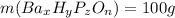 , тогда
, тогда
4) Найдем количества веществ:
5) Запишем отношение
Отсюда следует, что исходная формула соединения - это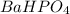
P.S.