Процесс ОВР представлен уравнением: 2CuO +C = CO2 + 2Cu
(а) Определите степени окисления элементов в реагентах и продуктах
Другие вопросы по теме Химия
Популярные вопросы
- А1 а) какое наименьшее число коробок потребуется, чтобы пересыпать 143 кг...
1 - Мне нужно до , выполните 5-6 задание там сказано- дано и решение...
1 - 1. Почему по жанровой разновидности произведение Старик и море обычно определяют...
3 - Составьте стих про Ашхабад надо, 3 или 4 куплета. Составлять нужно самим....
3 - При якому значенні рівняння 10 = 256 час корінь, що дорівнює числу -16?...
1 - Звідки взялися призвіська долгорукий ,Велике гніздо ,Калита ,Донський?...
3 - Як використали цінність знань Три святителі ?...
2 - Вкажіть рядок, в якому допущено помилку: підручник по літературі; за власним...
2 - 6. Нужно перевезти 1 080 q моркови на машине с прицепом. В каждую поездку...
2 - Найдите субъект, предикат и связку в суждении: 1. Региональная экополитика...
2
2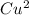 O+C⇒
O+C⇒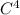 O2+2Cu
O2+2Cu
CuO является окислителем
C является восстановителем
2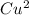 + 4 e- → 2 Cu (восстановле́ние)
+ 4 e- → 2 Cu (восстановле́ние)
C - 4 e- →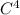 (окисление)
(окисление)
Объяснение:
1. Степень окисления атома любого элемента в свободном состоянии (это состояние элемента, когда он не связан с другими атомами в соединении) равна нулю. Например, атом кислорода (O2) имеет степень окисления равную нулю.
2. Степень окисления химического элемента в простом ионе равна заряду иона. Например, у иона натрия (Na+) степень окисления равна +1, а у иона кислорода в перекиси водорода (H2O2) степень окисления равна -1.
3. Степень окисления вещества считается положительной или отрицательной, в зависимости от электроотрицательности других элементов в соединении.
С учетом этих правил, мы можем определить степени окисления элементов в данном уравнении:
1. В реагентах:
- Кислород (O) обычно имеет степень окисления -2. В данном случае, в соединении CuO, медь (Cu) обычно имеет степень окисления +2, так как общий заряд соединения равен нулю.
- Углерод (C) обычно имеет степень окисления +4. В данном случае, в соединении C, углерод сохраняет свою степень окисления +4.
2. В продуктах:
- Кислород (O) продолжает иметь степень окисления -2. В данном случае, в соединении CO2, углерод (C) должен иметь степень окисления +4, чтобы общий заряд соединения равнялся нулю.
- Медь (Cu) имеет степень окисления +2. В данном случае, у образовавшихся ионов меди (Cu2+) должна быть степень окисления +2, чтобы общий заряд соединения равнялся нулю.
Таким образом, степени окисления элементов в данном уравнении составляют:
2CuO: +2 (Cu), -2 (O)
C: +4 (C)
CO2: +4 (C), -2 (O)
2Cu: +2 (Cu)
Надеюсь, я смог объяснить процесс определения степеней окисления элементов в данном уравнении понятным и обстоятельным образом. Если у вас возникнут еще вопросы - не стесняйтесь задавать!