При сжигании углеводорода образовалось 0,896 л углекислого газа и 0,72 г воды. относительная плотность углеводорода по азоту равна 1. найдите молекулярную формулу углеводорода
Другие вопросы по теме Химия
Популярные вопросы
- Знайдіть в Інтернеті таблицю кодів символів ASCII. Користуючись цією...
3 - країни і регіони світусвіту, де розвивається високотоварне тваринництво...
1 - Пауки-затейники решили собраться на стенах комнаты в форме куба. Если...
3 - Как Вы считаете, каковы были причины его обращения к исторической тематике?...
2 - Точки M і N належать відрізку AB (точка M лежить між точками A і N)...
3 - Одноклітинним організмом є А.евглена Б.людина В.грак Г.дощовий черв...
1 - При обработке алюминиевой детали на станке температура её повысилась...
1 - Разработать математическую модель и алгоритм решения задачи. Выполнить...
1 - Представити у вигляді степеня вираз(a⁶)²...
2 - Знайти кути трикутника із сторонами a=8 см, b=5см, c=9 см...
3
=>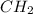 - простейшее вещество, т.е. такого нет => домножаем на 2 и получаем
- простейшее вещество, т.е. такого нет => домножаем на 2 и получаем 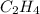 - этен.
- этен.
4) Зная, что плотность по азоту равна 1 => можно вычислить молярную массу этого вещества:
5) Теперь, когда мы знаем молярную массу этого вещества => можно проверить количество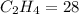 , всё подходит => мы вычислили.
, всё подходит => мы вычислили.
ответ: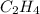 - этен.
- этен.