При сгорании 5,6 г некоторого вещества, состоящего из углерода и водорода, образовалось 17,6 г оксида углерода (iv). плотность вещества по водороду равна 28. вывести истинную формулу вещества
Другие вопросы по теме Химия
Популярные вопросы
- Вычислите какой объем водорода выделится при взаимодействии 4г.натрия с водой?...
1 - Прямые ас и вd пересекаются в точке о. в треугольниках вос и аоd: вс=аd, угол...
2 - Решить уравнение: (7x-37)*(-5x+9)=0...
2 - Катеты прямоугольного треугольника соответственно равны 7и 24 см найти расстояние...
2 - Выполнить морфологический разбор слова могучими...
1 - Решите уравнение log2 ( x - 4 ) = 3...
3 - Решите уравнение с проверкой 256: y=8...
1 - Решить . мама сварила 18 литров варенья.3 одинаковые банки малинового и 5 таких...
2 - Найдите произведение, используя свойства умножения: а) (-2) * (-6) * 5 * 15...
3 - Какое давление оказывает ртуть на дно сосуда если высота столба житкости 15см?...
3
Для начала определим относительную плотность искомого вещества.
Формула для вычисления относительной плотности:
D (по водороду) =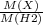 = 28 (молярная масса искомого вещества принята за Х).
= 28 (молярная масса искомого вещества принята за Х).
Тогда:
Х = 28 * M(H2) = 28 * 2 = 56 г/моль
В искомом веществе n(C) = m(CO2) : M (CO2) = 17,6 г : 44 г/моль = 0,4 моль (атомов углерода), соответственно:
m(C) = n(C) * M(C) = 0,4 моль * 12 г/моль = 4,8 г
Если все вещество весит 5,6 г, то, следовательно, масса атомов водорода:
m(H) = 5,6 г - 4,8 г = 0,8 г
поэтому представим искомую формулу углеводорода таким образом:
CxH2x
14x=56
x=4
значит, C4H8 - истинная формула вещества (бутен)
ответ: C4H8