При обжиге известняка получают два ценных продукта-негашеную известь cao и углекислый газ.оба вещества используются в сахарной промышленности .вычисли массу обоих оксидов,если масса известняка 100 кг.
Другие вопросы по теме Химия
Популярные вопросы
- 1.Талғаулы салалас құрмалас сөйлем дегеніміз … А) Жай сөйлемдердегі іс –...
2 - Часто меня томило тяжелое предчувствие СДЕЛАЙТЕ СИНТАКСИЧЕСКИЙ РАЗБОР...
3 - В предложенном списке отыщите вещество, у которого степень диссоциации в...
3 - Следующий член арифметической прогрессии 77;82... равен...
2 - Выпишите из рассказа Умирание ивы эпитеты, метафоры, сравнения и олецетворения...
3 - Укажи правильные утверждения. 1. Ионы кислотных остатков имеют отрицательные...
2 - Смотрите в источникенужен ответ на 4-5 задание...
2 - 1) Выберите трехосновную кислоту: а) Н2S б)HNO3 в) H3PO4 г) H2CO3 2) 2)3)...
3 - Отметьте значения переменных, которые записаны верно: ( с обьяснениями хочу...
2 - 3 если куплет мы обозначиваем буквой К а припев буквой П то купленную форму...
3
Дано:
m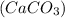 = 100кг. = 100000г.
= 100кг. = 100000г.
Найти:
m(CaO) - ?
m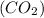 - ?
- ?
1)По уравнению реакции: n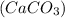 =n(CaO)=
=n(CaO)= 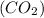 = m
= m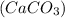 / M
/ M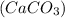 = 100000г. / 100 г/моль= 1000 моль;
= 100000г. / 100 г/моль= 1000 моль;
2) => m(CaO)= n(CaO) * M(CaO)= 1000 моль * 56 г/моль= 56000 г. или 56 кг.
3) => m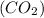 = n
= n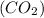 * M
* M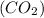 = 1000 моль * 44= 44000г. или 44кг.;
= 1000 моль * 44= 44000г. или 44кг.;
4) Можно было не рассчитывать с пмощью количества вещества массу углекислого газа! Зная закон о сохранении массы веществ (масса веществ до реакции, равна массе веществ после реакции), можно выщитать, что m1=m2, т.е, составив уравнение, обозначив за x (кг.)- массу углекислого газа:
100 = x + 56;
x = 44 (кг.).
ответ: m(CaO) = 56 кг.; m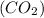 = 44 кг. Значит, Всё!
= 44 кг. Значит, Всё!
-------------------------------------------------------------------------------------------------
Есть вопросы? Задавай Если человек знает, чего он хочет, значит, он или много знает, или мало хочет."