При давлении 101,3 кПа и температуре 298,15 К вычислите изменение энергии Гиббса в результате реакции 4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (г)
Может ли эта реакция протекать самопроизвольно при указанных выше условиях?
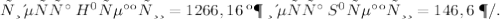
Другие вопросы по теме Химия
Популярные вопросы
- Какие факторы нужно учитывать при выборе клавиатуры для покупки?...
2 - Выбор монитора. В чем преимущество жидкокристаллических мониторов?...
3 - Для чего нужны устройства вывода?...
3 - Каков объем оперативной памяти у современных компьютеров?...
2 - Проведите стрелки от устройств ввода информации к компьютеру и от компьютера к...
2 - Заполните таблицу, записав в ней достоинства и недостатки трёх видов принтеров...
2 - Какими двумя основными параметрами характеризуемся информационная магистраль?...
2 - Какие три вида принтеров существуют?...
1 - Какие существуют виды дисководов для оптических дисков?...
1 - Компьютеры каких фирм имеют открытую архитектуру?...
1
- 1228,3 кДж Отрицательное значение энергии Гиббса указывает, что реакция может самопроизвольно протекать при данных условиях
Объяснение:
При давлении 101,3 кПа и температуре 298,15 К вычислите изменение энергии Гиббса в результате реакции
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (г)
Может ли эта реакция протекать самопроизвольно при указанных выше условиях?
NH3(4) О2 N2 H2O (г)
ΔH°₂₉₈ кДж/моль - 45,9 0 0 - 241,2
S°₂₉₈ Дж/моль ·K 192,8 205,2 191,6 188,8
ΔH₂₈₈ (реакц) = (- 241,2 ·6) - (-45,9 ·4) = - 1447, + 183,6 =
- 1447,2 + 183,6 = - 1263,6 кДж
ΔS°₂₉₈ (191,6·2 + 188,6· 6) - (192,8·4 + 205,2·3) = 1516,0 - 1386,8 = 129,2 Дж/моль ·К
ΔG = ΔH - T×ΔS = - 1263,6 - 273· 0,1292 = - 1228,3 кДж
Отрицательное значение энергии Гиббса указывает, что реакция может самопроизвольно протекать при данных условиях