При 60 градусов(C), растворимость хлорида бария составляет 39,55 г. Вычислите, какая масса BaCl2*2H2O может быть растворена в воде обьемом 400 мл. объясните как решить задачу
Другие вопросы по теме Химия
Популярные вопросы
- Распроси у друзей что особенно хорошо делают по дому их придуманные друзья...
3 - Решите систему уравнений4x+3y=2,x-4y=-9...
1 - 1. описать животных класса насекомые (особенности строения, питания, размножения)....
2 - А) 809 б)5211 в)22003008 г)28015302 д)507080000 е)1010009000 ж)423340600980...
3 - Подготовьте сообщение о природных сообществах г,воронежа 100...
3 - Одна бригада может выполнить за 40 дней а другая за 50 дней хватит ли...
2 - Прочитайте текст еще раз и установите соответствие между заголовками a-e...
3 - Имеют ли смысл выражения 1/5 моль, 1/5 молекулы и 1\5 массы молекулы....
1 - Общий признак земноводных и пресмыкающихся: а) мечут икру б) дыхание легочное...
2 - Cкем борются ромео и джульетта ? есть ли внутренняя борьба ?...
2
199.2 г
Объяснение:
Позначим количество вещества хлорида бария, который нужно растворить как х моль, тогда его масса в кристаллогидрате будет равна 208х г, а масса воды 36х г
Это нам нужно для того, что часть воды в которой мы растворяем хлорид бария будет идти из самого кристаллогидрата
Мы знаем, что 39.55 г соли может раствориться в 100 г воды
Запишем это в виде дроби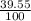
Точно такую же дробь мы составляем, только в расчете на 400 г воды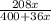
Приравниваем и ищем х
Ну и считаем массу всего кристаллогидрата