Определите объем углекислого газа, который образуется при растворении в азотной кислоте 250 граммов известняка, содержащего 20% примесей. решите все подробно , а то совсем не понимаю ((
Другие вопросы по теме Химия
Популярные вопросы
- Розв’яжіть систему рівнянь...
1 - 1.возникнит ли индукционный ток, если замкнутый контур двигать параллельно...
3 - • 2,3,4 – триетилізобензойна кислота • 2,3,4,5 – тетрахлоргексанова кислота...
1 - 8. Відомо, що з 1 т пролитої нафти утворюється на поверхні води пляма...
1 - «Сравнительная экономико-географическая характеристика США и Канады» 1....
1 - Викласти тротуарну доріжку довжиною 8м і шириною 80 см якщо ціна однієї...
1 - 1. Дайте характеристику Индексу глобальной конкуренто (ИГК). 2. Создайте...
2 - Як називаються угрупування в яких відсутні вожаки...
3 - Нужно записать 2 предложения и подчеркнуть глаголы сопряжение и вид ...
2 - Замени глаголы подходящими деепричастиями...
3
1)250 г - это известняк с примесями => вычислить примеси:
250 г - 100%
х г - 20% =>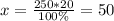 г - это примеси.
г - это примеси.
2) Нам нужно узнать массу ЧИСТОГО известняка, чтобы определить объём углекислого газа => 250 - 50 = 200г.
3) Находим кол-во вещества: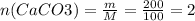 моль
моль
4)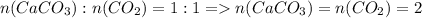 моль
моль
5)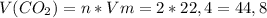 л
л
ответ: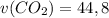 л
л