Объём водорода (н.у.), который выделится при взаимодействии 200 г 4,9%-ного раствора серной кислоты с 10 г магния, равен...???
Другие вопросы по теме Химия
Популярные вопросы
- Решите и дай бог вам здоровья...
3 - 1. Запишіть речення. Підкресліть граматичні основи. Визначте, якою...
3 - 5 класс. задание. 3.56) Представьте в виде суммы произведение: а)...
1 - 4 х 4 + 50 х 60 + косинус плюс 9 градусов Да я знаю это трудно но...
3 - Решите задачу: Пираты спрятали на острове сокровищ золотые монеты....
3 - , рассчитать токи в ветвях цепи, если R1=2,5 Ом, R2=5 Ом,R3=8 Ом,...
1 - 5 сынып Қазақ тілі 33бет 4тапсырма тауып беріңдерш 5 сынып оқитындар...
1 - Яких богів шанували в Стародавньому Єгипті? Хто з них був найшанованішим?...
2 - Елдің асыл тірегі Ата Заңы кімде бар...
2 - Глава I 1. Почему Троекуров имел «большой вес в губерниях»? 2. Как...
2
2,24 л
Объяснение:
Дано:
m(H₂SO₄)р-ра = 200 г
w(H₂SO₄) = 4,9% = 0,049
m(Mg) = 10 г
Найти:
V(H₂) - ?
Решение: H₂SO₄ + Mg → MgSO₄ + H₂↑
1) Найдем количество растворенной кислоты (т.к. раствор это вода+вещество, а в реакцию вступает вещество):
m(H₂SO₄) = 200·0,049 = 9,8 г
2) Найдем количество вещества (n, моль) реагентов: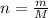 , где m - масса (г); M - молярная масса (г/моль).
, где m - масса (г); M - молярная масса (г/моль).
M(H₂SO₄) = 98 г/моль; M(Mg) = 24 г/моль
3) Сравниваем полученные значения:
n(H₂SO₄) < n(Mg)
Значит, кислота в недостатке, магний в избытке. Расчет всегда ведется по недостатку
4) Т.к. все вещества стехиометрически равны между собой (у всех одинаковые коэффициенты - 1), то количество вещества тоже равны:
n(H₂) = n(H₂SO₄) = 0,10 моль (т.к. считается по недостатку)
5) Считаем объем по формуле: V = Vm·n, где Vm - молярный объем, который для всех газов при н.у. равен 22,4 л/моль.
V(H₂) = 0,10·22,4 = 2,24 л
ответ: 2,24 л H₂