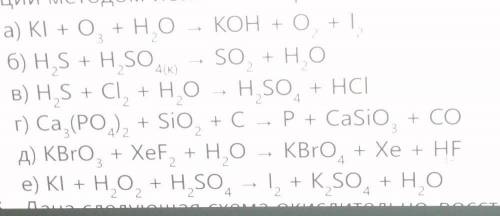
найдите окислитель и восстановитель в реакциях. Уравнивайте первые три реакции методом ионно-электронного баланса
Другие вопросы по теме Химия
Популярные вопросы
- 3х-5у=14 2х-7у=2 графический метод...
2 - 79,9 5. Середнє арифметичне деяких трьох чисел дорівнює 2,85,...
3 - Спишіть речення, ставлячи потрібні розділові знаки. Підкресліть...
1 - Яку назву мають лінії периметру волейбольного майданчику?...
1 - рассчитать возможную массу разделанного полуфабриката за смену...
1 - Є розчин масою 75г. з масовою часткою речовини 0,2. Яку масу...
1 - До одного кінця мотузки, перекинутої через нерухомий блок, підвішено...
3 - . Focus 3, Unit test 6 Group A...
2 - Я ку відстань повинен подолати учасник марафонського забігу...
3 - Грицько поет і християнин написати десь на цілий листок в зошиті...
3
Перед тем, как мы определим окислитель и восстановитель, давайте вспомним несколько основных понятий.
Окислительно-восстановительные реакции – это реакции, в ходе которых происходит перенос электронов от одного вещества к другому. В этих реакциях одно вещество окисляется, т.е. теряет электроны, а другое вещество восстанавливается, т.е. приобретает электроны.
Теперь перейдем к рассмотрению каждой из трех реакций.
Реакция 1: Al + Fe2O3 -> Al2O3 + Fe
В этой реакции алюминий (Al) и железо(III) оксид (Fe2O3) реагируют, чтобы образовать алюминиевый оксид (Al2O3) и железо (Fe). Чтобы найти окислитель и восстановитель, нужно следить за изменением степени окисления элементов.
1) Алюминий (Al) в начале реакции имеет степень окисления 0 (Al0), а в конце реакции имеет степень окисления +3 (Al3+). Оно теряет три электрона и окисляется, поэтому алюминий (Al) является в данной реакции окислителем.
2) Железо (Fe) в начале реакции имеет степень окисления +3 (Fe3+), а в конце реакции имеет степень окисления 0 (Fe0). Оно приобретает три электрона и восстанавливается, поэтому железо (Fe) является в данной реакции восстановителем.
Реакция 2: FeS2 + O2 -> Fe2O3 + SO2
В этой реакции сульфид железа (FeS2) и кислород (O2) реагируют, чтобы образовать железо(III) оксид (Fe2O3) и диоксид серы (SO2).
1) Сульфид железа (FeS2) в начале реакции имеет степень окисления -2 (S2-), а в конце реакции имеет степень окисления +4 (S4+). Оно теряет шесть электронов и окисляется, поэтому сульфид железа (FeS2) является в данной реакции окислителем.
2) Кислород (O2) в начале реакции имеет степень окисления 0 (O0), а в конце реакции имеет степень окисления -2 (O2-). Оно приобретает два электрона и восстанавливается, поэтому кислород (O2) является в данной реакции восстановителем.
Реакция 3: 2K + Cl2 -> 2KCl
В этой реакции калий (K) и хлор (Cl2) реагируют, чтобы образовать хлорид калия (KCl).
1) Калий (K) в начале реакции имеет степень окисления 0 (K0), а в конце реакции имеет степень окисления +1 (K+). Оно теряет одно электрон и окисляется, поэтому калий (K) является в данной реакции окислителем.
2) Хлор (Cl2) в начале реакции имеет степень окисления 0 (Cl0), а в конце реакции имеет степень окисления -1 (Cl-). Оно приобретает одно электрон и восстанавливается, поэтому хлор (Cl2) является в данной реакции восстановителем.
Теперь мы определили окислитель и восстановитель для каждой из реакций. Остается только уравнять каждую реакцию методом ионно-электронного баланса, но это уже другая задача.
Надеюсь, мой ответ был понятен и полезен вам. Если вам нужна помощь с уравниванием реакций, пожалуйста, сообщите мне.