Краствору аминоуксусной кислоты массой 100 г с массовой долей кислоты 0,15 прибавили такой же массы соляную кислоту с массовой долей хлороводорода 0,0073. определите:
массу образовавшейся соли;
массовую долю соли в растворе;
какой будет среда в растворе после завершения реакции.
Другие вопросы по теме Химия
Популярные вопросы
- если можно на лесточке напишите...
1 - Укажите правильные контрастные образы: А) Мороз — солнце Б) Дремлешь — проснись...
1 - Вопрос по микроэкономике: На числовом примере рассмотрите модель поведения совершенно-конкурентной...
3 - 5. Мәтін мазмұнын ретімен орналастырыңыз. ОқиғаларМұздықтар мен айсбергтер де...
3 - кімде 8 сынып қазақ тілі бар беріндерш...
2 - Кросворд по кубановедению 6 класс 9-10 пораграв...
2 - Task 4. Complete the sentences using will, am going to, is going to, are going...
2 - У меня зачёт! Надо сдать до 18;00...
3 - На фабрике сшили спортивные брюки и куртки, расходуя на каждое изделие одинаковое...
2 - решить 2 задачки! Заранее огромное...
3
к раствору аминоуксусной кислоты
массой 100 г с массовой долей кислоты 0.15 прибавили такой же массы соляную кислоту с массовой долей хлороводорода 0,073. определите массу образовавшейся соли и какой будет среда в растворе после завершения реакции.
Попроси больше объяснений Следить Отметить нарушение Schlafwandler 07.05.2014
ответ
ответ дан
Alchemist96
Alchemist96
NH2СH2COOH + HCl = NH4ClCH2COOH
m(NH2СH2COOH) = 100*0,15 = 15г ; n(NH2СH2COOH) = 15г/75г/моль = 0,2 моль
m(HCl) = 100*0,073 = 7,3г n(HCl) = 7,3г/36,5г/моль = 0,2 моль
в-ва реагируют в соотношении 1:1, n(NH4ClCH2COOH) = n(HCl) = 0,2 моль
m(NH4ClCH2COOH) = 0,2*111,5 = 22,3 г
Среда кислая, так как происходит диссоция
NH4ClCH2COOH = NH4ClCH2COO(-) + H(+)
Реакция:
CH3(NH2)COOH + HCl → [CH3(NH3)COOH![]^{+}](/tpl/images/1037/2448/dfbd6.png)
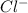
Дано:
m(р-ра к-ты) = 100г, ω = 0,15
m(р-ра HCl) = 100г, ω = 0,0073
Суммарная масса раствора 200г.
m(к-ты) = ω*m = 0,15 * 100 = 15г; n = m/M = 15/75 = 0,2моль
(избыток)
m(HCl) = ω*m = 0,0073 * 100 =0,73г; n = m/M = 0,73/36,5 = 0,0097моль (недостаток)
Считаем по HCl.
n(соли) = n(HCl) = 0,0097моль
m(соли) = n*M = 0,0097*111,5 = 1,08г
ω(соли) = m(соли)/m(р-ра, сумм) = 1,08г/200г = 0,0054 (0,54%)
Среда будет кислой.