Kmno4+ h3po3+h2so4-> mnso4+ h3po4+ k2so4+h2o пож. решить уравнение на овр
Другие вопросы по теме Химия
Популярные вопросы
- Чему будет равна переменная а после выполнения алгоритма:х:=5;а:=х;b:=a*2+5a:=a+b...
3 - Написать сочинение по плану. Рассказ Гоголя Тарас Бульба План: 1) Дома 2)...
1 - 1.Как вы думаете, может ли человек обойтись без друзей? Почему? 2.Что объединяет...
2 - Графіт(проста речовина) це метал чи неметал?...
2 - Кто Физику знает ответьте...
3 - який тип земної кори розміщений під поверхнею більшої частини україни океанічний...
2 - в тональностях ре, сиb, ля и миb мажорах построить, играть и петь - Т6, S35,...
2 - Тебе поручено подготовить развёрнутый ответ по теме «революция 1848 г. в германии»....
1 - Выберите одну из профессий и, постарайтесь, описать ее по типам профессиональной...
2 - Шинель. Гоголь. в департаменте не оказывалось к нему Никакого уважения«Оставьте...
3
5H3PO3+2KMNO4+3H2SO4=2MnSO4+5H3PO4+K2SO4+3H2O
p+4 -1e= p+5
mn+7 +5e= mn+2
Обычный электронный баланс намного удобнее
Методом полуреакций будет проще всего:
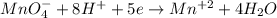 | 2
| 2
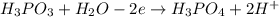 | 5
| 5
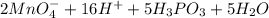 =
=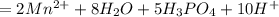
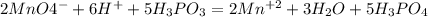
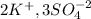
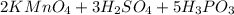
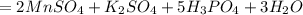
Сокращаем одинаковые ионы в правой и левой частях:
Добаляем необходимые ионы в правую и левую части:
Получаем: