Каково значение рН раствора, полученного из 0.2 г нитрата аммония и 250 мл воды? Плотность раствора принять равной 1г/мл. Температура 22 С. Нужно как-то решить по вот этой формуле:
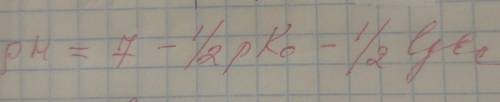
Другие вопросы по теме Химия
Популярные вопросы
- 87 613 + 665 760 : 95 + 103 ∙ (500 200 – 469 937) = ....
2 - .Проанализируйте сцену встречи Печорина и Веры в записи от 16...
2 - II. Вставьте правильный предлогfor, of, in, with, by, to, from,...
2 - Определить координаты точки Р. ( ). Показать нахождение координат...
1 - (-5/6*4/15-2/15):(-8)решит...
1 - Мини-сочинение по рассказу васюткино озеро 5-8 предложений что...
1 - Черчение. По двум видам построить 3 вид....
1 - это общество, у меня тупит...Проанализируй ситуацию и ответь на...
1 - Мэйдзи реформаларының 3 ерекшелігін сипаттаңыз....
3 - Решите уравнение: 2,6х-0,2(3х-9) = -0,5(2х+6)....
1
1. Определение количества вещества (n) нитрата аммония:
Масса нитрата аммония: 0.2 г
Молярная масса (M) нитрата аммония: 80.05 г/моль (N = 28.02 г/моль, O = 16.00 г/моль)
n = масса / молярная масса = 0.2 г / 80.05 г/моль = 0.0025 моль
2. Определение концентрации (C) нитрата аммония:
Объем воды: 250 мл = 250 г (плотность раствора равна 1 г/мл)
C = количество вещества / объем раствора = 0.0025 моль / 0.25 л (переводим миллилитры в литры) = 0.01 М (моль/л)
3. Определение ионизации нитрата аммония:
Нитрат аммония (NH4NO3) разлагается на ионы NH4+ и NO3-. В данном случае, NH4NO3 является разведенным электролитом и полностью ионизируется в растворе. Это значит, что каждая молекула NH4NO3 разлагается на 1 ион NH4+ и 1 ион NO3-.
4. Определение концентрации ионов Н+:
Поскольку каждая молекула NH4NO3 дает 1 ион NH4+, концентрация ионов Н+ будет равна концентрации нитрата аммония.
Таким образом, концентрация ионов Н+ = 0.01 М.
5. Определение значения рН:
pH - это отрицательный логарифм по основанию 10 от концентрации ионов Н+.
pH = -log[H+]
pH = -log(0.01)
pH = -(-2)
pH = 2
Таким образом, значение рН раствора, полученного из 0.2 г нитрата аммония и 250 мл воды, равно 2. Это означает, что раствор является кислотным.