Какова массовая доля азотной кислоты в растворе (в %), 400 г которого вступают во взаимодействие с избытком карбоната калия с образованием 28,28 г соли. ответ запишите числом с точностью до сотых, без единицы измерения, пробелов и знаков препинания. Например: 13,67
Другие вопросы по теме Химия
Популярные вопросы
- Чим відрізняється лисиця що впала з неба скорочена від повної...
2 - 15) Задание2. Определи, верны ли утверждения об этносоциальной...
1 - Какова идея сказка об одном зёрнышек 3-5 предллжений...
1 - Ищу друзей гачеров, кто хочет пишите я :)...
3 - Это впр помагите не могу решить...
3 - 2. Әр мәтін бойынша екі проблемалық сұрақ құрастырыңыз. А мәтіні...
2 - надо ответьте на вопросы по сказке М.Е. Салтыкова-Щедрина «Повесть...
3 - Какое из представленных множеств является пересечением множеств...
2 - 2х^-12х=18 а. (3х-1)^-х^=?...
2 - За і четверть по предмету «История Казахстана». 1. Определите...
3
4,41%
Объяснение:
Запишем уравнение реакции:
2HNO₃ + K₂CO₃ = CO₂ + H₂O + 2KNO₃
Найдём массу азотной кислоты, которая вступила в реакцию:
m(HNO₃) = 28,28 × 63 ÷ 101 = 17,64 грамм
Двойки в Mr сократились, поэтому мы их не записали.
Теперь рассчитаем ω(HNO₃) =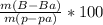 % = 17,64 ÷ 400 × 100% = 4,41%
% = 17,64 ÷ 400 × 100% = 4,41%