Каков знак изменения энтропии в процессе образования гидроксокомплекса Cr(III): 3NaOH + Cr(OH)3 - Na3[Cr(OH)6]
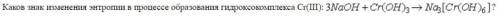
Другие вопросы по теме Химия
Популярные вопросы
- 1. какие государства возникли в западной европе к xi веку? 2. дайте...
1 - Сократить дроби буду ) a^3b^5/ab^7 -63xy^5/81xy^4 30a^2c^3/48a^3c^2...
1 - Найди 2 числа при сложении которых получиться число 240 а при вычитании...
3 - Решить уровнения и найти его значение3а+17+4а+8а - при 2,5 ...
1 - Bas 1. я - человеквек ирядуова-то втойде-кто есть человек? дети, на...
1 - 6класс, 1 часть параграф 2, кратко и , заранее )...
3 - Придумайте описание о царе сказка иван крестьянский сын и чудо юдо...
2 - Семеро по лавкам это поговорка или пословица? ...
3 - Азақ тiлi, опубликовано 07.09.2019 10: 57 тыйым сөздерді көшіріп жаз....
3 - 18. прочитайте. спишите. расскажите о ком или о чём говорится в каждом...
2
3NaOH + Cr(OH)3 -> Na3[Cr(OH)6]
Энтропия (S) является мерой хаотичности или "беспорядка" системы. Изменение энтропии (ΔS) можно определить сравнивая энтропию начальных веществ со суммой энтропий конечных веществ.
Изначально у нас есть 3 молекулы NaOH и одна молекула Cr(OH)3, а в конечных веществах имеем только одну молекулу Na3[Cr(OH)6]. Таким образом, в процессе образования гидроксокомплекса количество молекул уменьшается, и это может привести к уменьшению беспорядка или увеличению порядка в системе.
Таким образом, знак изменения энтропии (ΔS) в процессе образования гидроксокомплекса Cr(III) будет отрицательным (ΔS < 0). Это означает, что в данном процессе энтропия системы уменьшается, и процесс идет в сторону увеличения порядка.
Обоснование: Так как в начальных веществах у нас имеется больше молекул, чем в конечных, то происходит снижение вариативности (комбинаторной свободы) частиц в системе. Последствием этого будет уменьшение количества микростепеней свободы, что приведет к уменьшению энтропии.
Пошаговое решение:
1. Определите количество молекул в исходных и конечных веществах:
- Исходные вещества: 3 молекулы NaOH и 1 молекула Cr(OH)3.
- Конечное вещество: 1 молекула Na3[Cr(OH)6].
2. Сравните количество молекул в исходных и конечных веществах:
- У исходных веществ имеется 3 + 1 = 4 молекулы.
- У конечного вещества имеется 1 молекула.
3. Сделайте вывод о изменении энтропии:
- Исходя из сравнения количества молекул, можно сделать вывод, что количество молекул уменьшилось, а значит уменьшилась энтропия системы. Знак изменения энтропии будет отрицательным (ΔS < 0).
Таким образом, знак изменения энтропии в процессе образования гидроксокомплекса Cr(III) будет отрицательным (ΔS < 0), что указывает на уменьшение энтропии системы в данном процессе.