Какая масса известняка сасоз растворилась при взаимодействии 14,6 г раствора соляной кислоты с массовой долей 20 процентов? внимание пунктов много, написать полное решение обязательно , а? кто в рубит? вообще не понимаю её(
Другие вопросы по теме Химия
Популярные вопросы
- Предложение со словом козы составьте предложение со словом козы...
3 - Сочинение по рассказу выстрел с монитора крапивина. 70 !...
1 - Найдите ошибки и недочёты в построении сложноподчиненных предложений....
3 - Составте по 1 предложению с каждым словом от того, по этому, в...
2 - X^4 -(3k+2)x^2+k^2=0 при каком значение k корень уравнения составит...
3 - Что вы знаете о жизни судьбе в. а корнилова, п. с нахимова, в....
3 - Почему в формуле для нахождения диагоналей n(n-3)3? и почему в...
1 - Первая бригада может посадить 300 деревьев за 10 часов а второй...
1 - Самое главно с 13 остальное если сможете...
3 - Пловец проплывает по течению реки 2 км за 30 мин . скорость течения...
3
Уравнение реакции:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
1) Дан раствор соляной кислоты - HCl, дано процентное содержание кислоты в растворе, дана масса раствора. Дано это все не просто так, рассчитаем массу кислоты в растворе.
m(HCl) = w*m(р-ра) =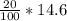 = 2.92грамм
= 2.92грамм
2) Рассчитаем количество вещества кислоты:
По уравнению реакции:
3)Рассчитаем массу известняка:
m(CaCO3) = n(CaCO3)*M(CaCO3) = 0,04моль*100г/моль = 4грамма
ответ: масса известняка растворившаяся при взаимодействии его с раствором соляной кислоты равна 4 грамма
CaCO3 + 2HCl => CaCl2 + CO2 + H2O
1) m (кислоты) = 14,6*20% = 14,6*0,2 = 2,92(г)
2) m(HCl) / M(HCl) = m(из-няка) / M(из-няка)
M - молекулярная масса, отсюда
m(из-няка) =m(HCl)* M(из-няка) / M(HCl) = 2.92*100 / 73 = 4(г) - масса известняка СаСОз,
которая растворилась