Как вычислить ph раствора двух солей, типо раствор 0.2л,
соли nabr(0.1 моль) и nacl(0.1
Другие вопросы по теме Химия
Популярные вопросы
- Можно ли пить водородную воду детям? и почему?...
2 - Ухлопчика і група крові (за системою ав0), у його матері – іі, у батька –...
2 - Умножение многочлена на одночлен. (^-степень) а) 2x^2y*(y^2-3xy^2+x) б) а*(а^2-3a)+4*(a^2-1)...
3 - Найти сумму и произведение 2x^2-3x-4=0...
3 - Длина отрезка dk равна 10 см найдите на прямой dk все точки для каждой из...
3 - 10 1)фамилия , имя автора; название произведения с жанром 2)главные герои...
3 - Чем интересно произведение критики ?...
3 - Чем интересно произведение критики ....
2 - Сочинение что делает человека умнее 10-15 предложений...
3 - Чему равно значение выражения √35-√7 / √5...
2
Ты выбрал(а) не очень удачный пример. Соли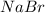 и
и 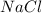 образованы сильным основанием (
образованы сильным основанием ( 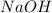 ) и сильными кислотами (
) и сильными кислотами ( 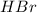 и
и 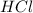 соответственно). Такие соли не влияют на кислотность среды, т.к. не проходит гидролиз:
соответственно). Такие соли не влияют на кислотность среды, т.к. не проходит гидролиз:
NaCl
NaBr
Приведу свой пример подобной задачи на вычисление pH:
Дано: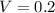 л ;
л ; 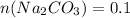 моль.
моль.
Найти: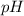 .
.
1) Найдём молярную концентрацию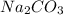 в растворе:
в растворе:
2) Запишем уравнение диссоциации соли:
3) Гидролиз:
Далее нам понадобится константа основности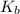 - справочная величина, обычно она дана в условии задачи.
- справочная величина, обычно она дана в условии задачи.
Зная константу основности, можно найти степень дисооциации:
Найдём степень диссоциации альфа:
ответ: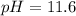 .
.
Советую почитать дополнительную литературу ( например, эта тема есть в бесплатном учебнике Фоксфорда ).
УДАЧИ! :)