К/p завтра, не знаю что ! контрольная работа «классы неорганических соединений» вариант 1. 1. напишите уравнения всех возможных реакций между следующими веществами: оксид лития, гидроксид натрия, серная кислота, оксид углерода (iv). 2. напишите уравнения реакций, с которых можно осуществить цепочку превращений веществ: p → p2o5 → h3po4 → k3po4 → ca3(po4)2 → h3po4 3. по названиям веществ составьте их формулы: фосфат алюминия, сульфид серебра, оксид марганца (vii), гидроксид магния, хлорид аммония, нитрат свинца (ii). 4. напишите уравнения реакций, в результате которых образуется: а) сульфат магния, б) гидроксид кальция. найдите возможно большее число различных вычислите массу осадка, образовавшегося в результате взаимодействия 1,7 г нитрата серебра с хлоридом меди, взятом в избытке. 6. определите, какое количество вещества оксида кальция прореагировало с серной кислотой массой 14,7 г. какая масса соли образовалась? 7. в трех пробирках без этикеток находятся растворы карбоната натрия, сульфата натрия, нитрата натрия. как путем распознать, какое вещество находится в каждой из пробирок? напишите уравнение реакций; ход распознавания представьте в виде таблицы. контрольная работа «классы неорганических соединений» вариант 2. 1. напишите уравнения всех возможных реакций между следующими веществами: оксид кальция, гидроксид калия, соляная кислота, оксид серы (vi). 2. напишите уравнения реакций, с которых можно осуществить цепочку превращений веществ: na → naoh → na2so3 → nacl → na2so4 → baso4 3. по названиям веществ составьте их формулы: оксид магния, иодид калия, хлорид меди (ii), нитрат железа (iii), гидроксид бария, карбонат аммония. 4. напишите уравнения реакций, в результате которых образуется: а) хлорид цинка, б) ортофосфорная кислота. найдите возможно большее число различных вычислите массу осадка, образовавшегося в результате взаимодействия 5,2 г хлорида бария с раствором серной кислоты, взятой в избытке. 6. вычислите массу и количество вещества образовавшейся соли, если известно, что в реакцию вступило 7,3 г соляной кислоты и 0,5 моль оксида меди (ii). 7. в трех пробирках без этикеток находятся растворы сульфата алюминия, сульфата калия, хлорида бария. как путем распознать, какое вещество находится в каждой из пробирок? напишите уравнение реакций; ход распознавания представьте в виде таблицы.
Другие вопросы по теме Химия
Популярные вопросы
- _ депозиты - это вклады денежных средств ограниченных размеров, имеющие строго...
2 - Только организация-монополист для повышения прибыли прибегает к ценовой дискриминации...
1 - Кривая, любая точка которой показывает сочетание факторов, дающих одинаковые...
3 - К кредитным организациям применяются явочные, нормативные, рекомендательные...
2 - Человек, не имеющий работу, но желающий работать и активно ищущий работу, учитывается...
1 - Характер переживаемого в настоящее Россией кризиса в основном трансформационный...
2 - Устойчивость денег в современных условиях определяется их количеством в обращении...
1 - Никогда не принимает U-образную форму кривая средних постоянных издержек средних...
1 - Рыночной экономике свойственной тождество частных и общественных интересов...
2 - Признаком кредитных денег является выпуск их в обращение посредством кредитных...
1
1 )оксид лития-Li2O
гидроксид натрия NaOH
Серная кислота - H2SO4
Оксид углерода - CO2
2 NaOH + H2SO4= Na2SO4 + 2 H2O
Li2O + H2SO4 = Li2SO4 + H2O
Li2O + CO2 = Li2CO3 ( при нагревании )
CO2 + 2 NaOH(избыток или расплав) = Na2CO3 + H2O
CO2(избыток) + NaOH = NaHCO3
2)
4 P+ 5 O2 = 2 P2O5 ( На самом деле: P4 (фосфор- белый) + 5 O2 = P4O10 P.S все немного сложнее) для общего развития реакция идет примерно так но в школе писать не советую, если интересно посмотрите )
P2O5 + H2O = H3PO4 ( опять же реакция для школьной химии )
3 KOH + H3PO4 = K3PO4 + 3 H2O
K3PO4 + Сa(OH)2 = Ca3(PO4)2↓ + KOH
Ca3(PO4)2 + 3 H2SO4 = 2 H3PO4 + 3 CaSO4
3)
фосфат алюминия- Al PO4
сульфид серебра - Ag2S
оксид марганца - MnO3
гидроксид магния Mn(OH)2
хлорид аммония NH4Cl
нитрат свинца (II) Pb (NO3)2
4)
a) Mg+ CuSO4 = MgSO4 + Cu
4 Mg + 5 H2SO4(концентрированная) = 4 MgSO4 + H2S↑ + 4 H2O
б) CaO+ H2O= Ca(OH)2
Ca(NO3)2 + KOH = KNO3 + Ca(OH)2↓
Ca + H3PO4 = Ca
5) 2AgNO3 + CuCl2 = 2AgCl↓ + Cu(NO3)2
Дано: Решение:
m(AgNO3) = 1,7 г n ( AgNO3) = m/M =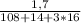 = 0,01 моль = n(AgCl)
= 0,01 моль = n(AgCl)
m ( AgCl) - ? m (AgCl)= n(AgCl) * M(AgCl)= 0,01 моль*
(108г/моль+35,5г/моль) = 1,435 г
ответ: 1,435 г
P.S. n- количество вещества ( еще обозначают как ν - "ню" )
6) CaO + H2SO4 = CaSO4 + H2O
Дано: n (CaO) - ?
m(H2SO4) = 14,7 г
n(H2SO4) = m/M = 14,7 г/ (2г/моль+32г/моль+4*16г/моль) = 0,15 моль=
= n(CaSO4)
m(CaSO4) = n*M = 0,15 моль*(40г/моль + 32г/моль+4*16г/моль)= 15,3 г
7)
Я не могу тут сделать нормальную таблицу, поэтому пусть это таблица : по горизонтали то что мы добавляем в пробирки по вертикали признаки реакции
----- | HNO3 | Ba(NO3)2
Na2CO3 | CO2↑ | помутнение воды
NaNO3 | -- | --
Na2SO4 | -- | осадок
Na2CO3 +2 HNO3 = H2O + CO2↑ + 2NaNO3
NaNO3 + HNO3 ≠
Na2SO4 + HNO3 ≠
Na2CO3 + Ba(NO3)2= BaCO3↓ + 2 NaNO3
Na2SO4 + Ba(NO3)2 = BaSO4↓ + 2 NaNO3