К 50 г 15% раствора хлорида бария прилили избыток раствора сульфата цинка. Рассчитайте массу образовавшегося осадка РЕШЕНИЕ!)
Другие вопросы по теме Химия
Популярные вопросы
- Напешите химические формулы каждого из указоных веществ Литий-Водород - Оксид калция-Корбонат...
2 - 1.Укажіть значення слова “бароко” ( )Г)дивний, химернийВ)приємний, ласкавийА)філософський,...
1 - можете писать на русском.3аранее Накреслить схему ділянки кола, яке складається...
2 - Целое число B делится на два различных простых числа p и q без остатка. Определите...
1 - Шыгыс ренессиясы туралы конспект жазу конспектти даптерге жазсангдар жибернгдерши...
2 - Распространи предложения однородными членами.Перетащи слова в предложении по схемам....
3 - $ 91. ОБОБЩАЮЩЕ, Соедините части предложений так, чтобы у вас получились после.вицы....
1 - Чим відрізняється глобалізація від інтеграції? Чем отличается глобализация от интеграции?...
3 - Что сделал Берман для девушки?...
1 - Точки А і Е симетричні відносно точки Р. Е(1; – 4), А(–5; 2). Знайдіть координати...
3
Дано:
ω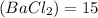 %
%
Исходя из этого получается: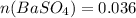 моль.
моль.
ответ: Масса образовавшегося осадка равна 8,4 г.