I2 + naoh→ naio3 + h2o
kmno4 + h2o2 + h2so4 → mnso4 + o2 + k2so4 +h2o
составьте электронные уравнения. расставьте коэффициенты в уравнениях реакций методом электронного . для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое – восстанавливается. определите тип окислительно – вос- становительных реакций.
Другие вопросы по теме Химия
Популярные вопросы
- Окружающий мир 4 класс доклад на тему чёрное море...
3 - Как расписовать пример 34+9умножеть на 4...
1 - Поделить на слоги и поставить ударение рита и рома искали в лесу...
2 - Постройте график с линейной функции y=1/2x+1...
2 - Найти сравнения. нашу речку словно в сказке за ноч вымостил мороз...
3 - Найти сравнения дружные ручки живут как братишки любят и мяч и ракету...
2 - Найти координаты векторов ав св если а(2; 3) в(-4; 1) с(-3; -2)...
1 - Jane (to ride) a bike в паст симпле, в паст континес,в паст перфект,в...
1 - Знаешь экскурсию отправляется 260 человек. сколько нужно заказать автобус,...
2 - Учащимися в процессе исследования свойств раствора выданной соли было...
2
1) 6I₂ + 12NaOH →10 NaI + 2NaIO₃ + 6H₂O ; реакция диспропорционирования
2) 2KMnO4 + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + 5O₂ + K₂SO₄ +8H₂O ; межмолекулярная ОВР
Объяснение:
1) I₂ + NaOH → NaI + NaIO₃ + H₂O
5|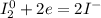 - восстановление (окислитель - I₂)
- восстановление (окислитель - I₂)
1|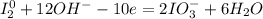 - окисление (восстановитель - I₂)
- окисление (восстановитель - I₂)
Добавляем к каждому аниону натрий:
Получаем:
6I₂ + 12NaOH →10 NaI + 2NaIO₃ + 6H₂O
Тип ОВР - реакция диспропорционирования (I₂ выступает и в роли окислителя, и в роли восстановителя)
2) KMnO4 + H₂O₂ + H₂SO₄ → MnSO₄ + O₂ + K₂SO₄ +H₂O
2|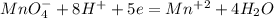 - восстановление (окислитель - KMnO4)
- восстановление (окислитель - KMnO4)
5|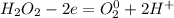 - окисление (восстановитель - H₂O₂ )
- окисление (восстановитель - H₂O₂ )
Добавляем к каждому аниону калий, а катиону - SO₄:
Получаем:
2KMnO4 + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + 5O₂ + K₂SO₄ +8H₂O
Тип ОВР - межмолекулярная ОВР (окислитель и восстановитель - разные вещества)