Химия: определите, какая из реакций окислительно-восстановительная, у неё определите окислитель и восстановитель, расставьте коэффициенты методом электронного баланса. У реакции, которая не ОВР, коэффициенты определите обычным математическим
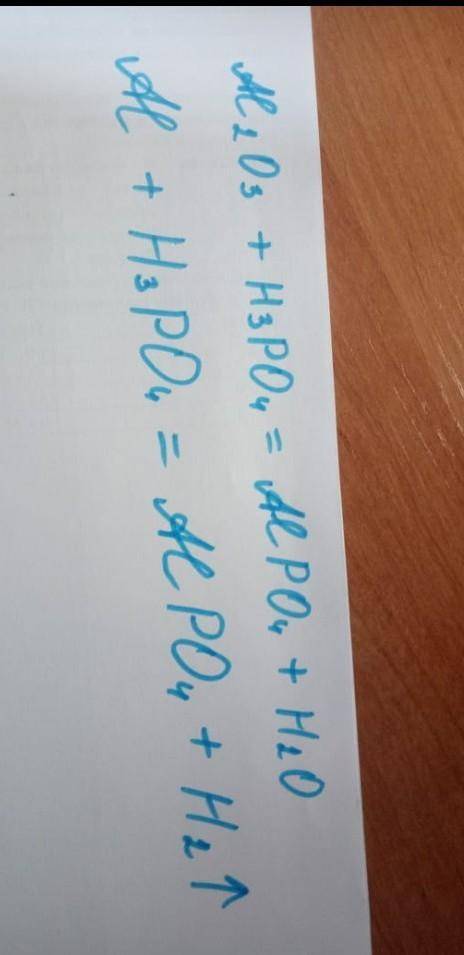
Другие вопросы по теме Химия
Популярные вопросы
- Ребзя с проектом надо написать про стариную вещь но я не могу придумать...
3 - 1 The US flag is on on 4th July, Independance Day 2 The of the US...
3 - Повідомлення на тему «Українська діаспора»...
3 - Написать текст на 12 предложений Лиза 14 лет ходу на художку три...
1 - Твір про повість русалонька із 7 в надо ааа...
2 - 20. Выполните действия: (1 3 5 +1,8)* 1 2 ; 4) (5,4-2 1 3 ):7 2...
1 - Напишите отношение, обратные данным:17:5; 3/2; 12:11; 36/ 13...
1 - Составьте предложение из этих слов предложение из слов:страна, статус,...
1 - Какова наименования площадь квадрата, если он делиться без остатка...
1 - 1) 11+5x=55+3x; 2) -8x-17=3x-105;3) 2(2+y)=19-3y;4) -3(3b+1)-12=12!только...
2
Объяснение:
1)
НЕ являеется ОВР (это реакция ионного обмена)
Поэтому уравниваем по числу ионов
2Al слева --> 2 перед AlPO4 --> 2 перед Н3РО4;
Для уравнивания О и Н ставим 3 перед Н2О.
Итог:
2)
А это - ОВР.
В реакции окислителем является
окислитель - водород Н - восстанавливается
со ст.ок. (+1) - до ст. ок. (0)
восстановитель - алюминий Al - окисляется
со ст.ок. (0) - до ст. ок. (+3)
Или, с учетом того, что справа молекула Н2:
Следовательно, коэффициенты:
2 перед Al; 2 перед AlPO4;
2 перед H_3PO_4; 3 перед Н2: