химия 8 класс Кусочек цинка массой 13 грамм полностью растворился в растворе серной кислоты. Вычислите массу образовавшейся в данной реакции соли.
Вычислите массу газа, который выделился в результате реакции между металлическим магнием и раствором соляной кислоты массой 127,3г.
Другие вопросы по теме Химия
Популярные вопросы
- Сколько школьных учебников размером в 512 кбайт можно разместить...
1 - Придумать рассказ с описанием или рассуждением 3 класс...
2 - Как современники оценивали внешнюю политику германии...
2 - Семь икс минус ( 8 плюс 4 икс минус 3 икс в квадрате ) плюс 5 минус...
2 - Write the english text size of 10 proposals as my family is preparing...
1 - Замените глаголы в неопределенной форме глаголами в повелительном...
3 - Таксист за месяц проехал 9000 км.стоимость одного литра бензина...
1 - На пришкольном участке школьники посеяли 145 г семян свеклы, семян...
3 - Прочитайте текст и заполни пропуски 1.(to ten. he 2.(like) to run....
2 - Семья ночью подошла к мосту. папа может перейти его за 1 минуту,...
3
32,2 г, 39 литров
Объяснение:
1) Запишем уравнение реакции:
Zn + H₂SO₄ = ZnSO₄ + H₂
n(Zn) = n(ZnSO₄) = 13 г / 65 г/моль = 0,2 моль
m(ZnSO₄) = 0,2 моль * 161 г/моль = 32,2 г
2) Запишем уравнение реакции:
Mg + 2HCl = MgCl₂ + H₂
n(HCl) = 127,3 г / 36,5 г/моль ≈ 3,4877 моль
n(H₂) = 1/2 n(HCl) = 1,74385 моль
V(H₂) = 1,74385 моль * 22,4 л/моль ≈ 39 л
Задача №1
Дано:
m(Zn)=13 г
-----
Найти:
m(соли) - ?
Решение
Реакция: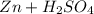 ⇒
⇒ 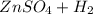 ↑
↑
ν(Zn) =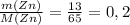 моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
моль (m - масса в (г) [граммы], M - молярная масса, берется из таблицы Менделеева, измеряется в г/моль [грамм поделить на моль] - грамм и грамм сокращаются, остается моль)
Тогда:
ν(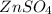 ) = ν(Zn) = 0,2 моль
) = ν(Zn) = 0,2 моль
*молярная масса сульфата цинка была посчитана из таблицы Менделеева: M(Zn) + M(S) + 4*M(O) = 65 г/моль + 32 г/моль + 4*16 г/моль = 161 г/моль
ответ: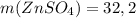 г
г
Задача №2
Дано:
m(HCl) = 127,3 г
-----
Найти:
m(газа) - ?
Решение
Реакция: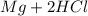 ⇒
⇒ 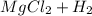 ↑
↑
ν(HCl) =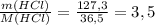 моль
моль
Тогда:
ответ: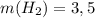 г.
г.