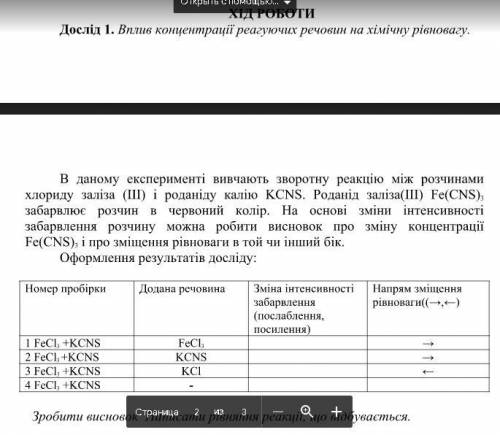
Дослід 1. Вплив концентрації реагуючих речовин на хімічну рівновагу.
В даному експерименті вивчають зворотну реакцію між розчинами
хлориду заліза (III) і роданіду калію KCNS. Роданід заліза(III) Fe(CNS) 3
забарвлює розчин в червоний колір. На основі зміни інтенсивності
забарвлення розчину можна робити висновок про зміну концентрації
Fe(CNS) 3 і про зміщення рівноваги в той чи інший бік.
Зробити висновок Написати рівняння реакції, що відбувається.
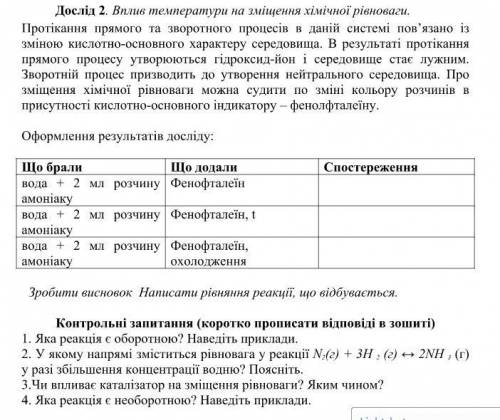
Дослід 2. Вплив температури на зміщення хімічної рівноваги.
Протікання прямого та зворотного процесів в даній системі пов’язано із
зміною кислотно-основного характеру середовища. В результаті протікання
прямого процесу утворюються гідроксид-йон і середовище стає лужним.
Зворотній процес призводить до утворення нейтрального середовища. Про
зміщення хімічної рівноваги можна судити по зміні кольору розчинів в
присутності кислотно-основного індикатору – фенолфталеїну.
Оформлення результатів досліду:
Що брали Що додали
вода + 2 мл розчину
амоніаку
Фенофталеїн
вода + 2 мл розчину
амоніаку
Фенофталеїн, t
вода + 2 мл розчину
амоніаку
Фенофталеїн,
охолодження
Зробити висновок Написати рівняння реакції, що відбувається.
Контрольні запитання (коротко прописати відповіді в зошиті)
1. Яка реакція є оборотною? Наведіть приклади.
2. У якому напрямі зміститься рівновага у реакції N 2 (г) + 3H 2 (г) ↔ 2NH 3 (г)
у разі збільшення концентрації водню? Поясніть.
3.Чи впливає каталізатор на зміщення рівноваги? Яким чином?
4. Яка реакція є необоротною? Наведіть приклади.
Ответы
Показать ответы (3)
Другие вопросы по теме Химия
Популярные вопросы
- Зависимость скорости велосипедиста от времени выражается уравнением...
1 - Уравнение скорости движения тела V = 8 + 2t (м/с). Укажите значения...
3 - Межпланетная станция «Марс-1», имея начальную скорость 12 км/с,...
1 - Фантастический проект и современность. В книге о путешествии к Луне...
3 - В лабораторном журнале М. В. Ломоносова приведены следующие данные...
2 - С каким ускорением двигались санки, если они скатились без начальной...
1 - Проверьте своего друга на быстроту реакции. Для этого метровую линейку,...
3 - В каких случаях две силы 4 и 3 Н, приложенные к одной точке, имеют...
1 - Деталь закреплена в трёхкулачковом патроне. Чему равна равнодействующая...
3 - В опыте с наклонной плоскостью Галилей установил, что пути, проходимые...
1