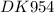для нейтрализации смеси, состоящей из Ca(OH)2 и KOH расхода 0,26 моль уксусной кислоты. Определите массу исходной смеси, если в растворе образовалось 9,8 г ацетата калия
Другие вопросы по теме Химия
Популярные вопросы
- 4. решите . взвесили 5 мешков картофеля и 4 мешка свеклы. общая...
3 - Сочинение по пословице на тему разлука с родиной тяжелое испытание...
3 - Устаршего брата 12 конфет,а у младшего 2 конфеты.сколько конфет...
3 - Сданным перепишите следующие предложения; подчеркните participle...
1 - Счерез онлайн-переводчики)london 1. london is where the invading...
1 - Записать 5 слов,в которых мягкость согласных обозначена буквами...
2 - Вау скоро совет как жи я, хочу попасть туда. -! два часа голову...
3 - Вторая мировая война! кто правил - правитель и страна....
2 - 3влияние хозяйственной деятельности человека на растительный мир...
1 - Вычислить длину вектора m=(4a--b), если даны координаты векторов...
3
Дано:
n(CH₃-COOH) = 0,26 моль
m(CH₃-COOK) = 9,8 гр
Найти:
m(Ca(OH)₂) - ?
m(KOH) - ?
1) Для начала мы запишем уравнений реакций при нейтрализаций смеси, именно по таким уравнениям мы будем пользоваться:
Ca(OH)₂ + 2CH₃-COOH → (CH₃-COO)₂Ca + 2H₂OKOH + CH₃-COOH → CH₃-COOK + H₂O2) Далее находим количества вещества у ацетата калия, а потом у гидроксида калия:
M(CH₃-COOK) = 12 + 1×3 + 12 + 16 + 16 + 39 = 12 + 3 + 83 = 98 гр/моль
n(CH₃-COOK) = m(CH₃-COOK)/M(CH₃-COOK) = 9,8 гр / 98 гр/моль = 0,1 моль ⇒ n(KOH) = n(CH₃-COOH) = 0,1 моль
3) Теперь находим массу гидроксида калия:
M(KOH) = 39 + 16 + 1 = 56 гр/моль
m(KOH) = n(KOH) × M(KOH) = 0,1 моль × 56 гр/моль = 5,6 гр
4) Теперь находим количества вещества уксусной кислоты, которое образовалось из реакций при добавление KOH:
n₂(CH₃-COOH) = n(CH₃-COOK) = 0,1 моль
5) Далее находим количества оставшейся уксусной кислоты образовавшееся в 1-ой реакций при добавлений Ca(OH)₂ :
n₁(CH₃-COOH) = n(CH₃-COOH) - n₂(CH₃-COOH) = 0,26 моль - 0,1 моль = 0,16 моль
6) Теперь находим количества вещества у гидроксида кальция из 1-ой уравнений реакций:
n(Ca(OH)₂) = 1/2 × n₁(CH₃-COOH) = 1/2 × 0,16 моль = 0,08 моль
7) Теперь находим массу гидроксида кальция:
M(Ca(OH)₂) = 40 + (16 + 1)×2 = 40 + 17×2 = 40 + 34 = 74 гр/моль
m(Ca(OH)₂) = n(Ca(OH)₂) × M(Ca(OH)₂) = 0,08 моль × 74 гр/моль = 5,92 гр
ответ: m(Ca(OH)₂) = 5,92 гр m(KOH) = 5,6 гр
Решено от :