Через известковую воду пропустили углекислый газ. в результате образовалась кислая соль и выпало 6 г осадка. после длительного кипячения раствора масса осадка увеличилась на 2 г. а) определите объем углекислого газа (н. поглощенного известковой водой. б) рассчитайте объем углекислого газа (н. который выделится при полном разложении осадка, полученного в результате описанного эксперимента.
Другие вопросы по теме Химия
Популярные вопросы
- Составить предложение по немецкому языку из слов 1 Main Vater,Salsa tanzen 2...
1 - Найдите площадь прямоугольного треугольника см^2,если его высота делит гипотензу...
3 - Лидер,независимый,сердце,живёт,прекрасный,страна,рядом,тысяча. Запишите солва...
3 - Почему в Новгородской и Псковских землях в конце 15 века начинает распространятся...
1 - Физика, 8 класс. В какой момент неучтённые потери тепла наибольшие?...
1 - Сколько литров h2 образуется при взаимодействии 8 грамма кальция с водой...
3 - Задумано три натуральных числа так, что произведение любых двух из них даёт...
1 - Установите последовательность процессов энергетического обмена: 1. Синтез 36...
2 - Визначити кінетичну енергію каменя масою 0, 2 кг кинутого вертикально вгору...
1 - (там надо подчеркнуть однородные члены)...
2
Реация:
Отсюда, m(Ca(HCO3)2) = 6g.
Распишем так:
M(Ca(HCO3)2) = 162 g\m -> 162 g.
M (CO2) = 22.4 l\m (при 1 моли) -> 44.8
V(CO2) =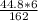 ~ 1.65 l
~ 1.65 l
Теперь пишем вторую реакцию.
Т.к. масса осадка по задачи увеличилась на 2 г., то получим, что Ca(HCO3) = 8g! (а не 6)
пишем анологичное:
M(Ca(HCO3)2) = 162 g\m
M(CO2) = 22.4 l\m
V(CO2) =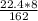 ~ 1.106.. ~ 1.1 l
~ 1.106.. ~ 1.1 l
ответ: а) ~1.65 l б) ~1.1 l
P.S. Пока я решал, я где то вроде допустил ошибку, если оно есть, в лс! =)