Чему равна молярная концентрация 16% раствора NH4CL плотностью 1,148 г/см3
Другие вопросы по теме Химия
Популярные вопросы
- Какой поучительный урок я получил после прочтения погорельского чёрная курица...
2 - Какие мысци использует рыба гля того чтобы плавать?...
2 - Написать сочинение на тему; почему а.дубровский начал разбойничать?...
1 - Среакциями ! al(oh)3 + h3po4 al(oh)3 + 3h3po4 2al(oh)3 + 3h3po4...
1 - Как зарождается и как протекает конфликт в межличностных отношениях....
3 - Выделите в стихотворениях б.слуцкого синонимы и антонимы. какова их функция...
1 - Рій бджіл полетіло збираьи нектар. 1/3 частина бджіл опустилася на квіти акації,...
1 - Какая влажность воздуха, если температура сухого градусника 25 градусов, а...
1 - Решите уравнение 26-(х+3х)-10066=854...
2 - Предпосылки освободительной войны в нидерландах...
3
Дано:
ω(NH₄Cl) = 16%
ρ(р-ра NH₄Cl) = 1,148 гр/см³
----------------------------------------
Найти:
1) Для начала мы найдем массу раствора хлорида аммония:
Допустим у нас имеется 100 мл (100 см³ или 0,1 л) данного раствора, тогда:
m(р-ра NH₄Cl) = ρ(р-ра NH₄Cl) × V(р-ра NH₄Cl) = 1,148 гр/см³ × 100 см³ = 114,8 гр
2) Далее находим массу чистого вещества хлорида аммония по такой формуле:
m(NH₄Cl) = m(р-ра NH₄Cl) × ω(NH₄Cl)/100% = 114,8 гр × 16%/100% = 114,8 гр × 0,16 = 18,368 гр ≈ 18,37 гр
3) Далее находим молекулярную массу хлорида аммония:
M(NH₄Cl) = 14+1×4+35,5 = 14+4+35,5 = 53,5 гр/моль
4) Теперь находим количество вещества хлорида аммония:
n(NH₄Cl) = m(NH₄Cl)/M(NH₄Cl) = 18,37 гр / 53,5 гр/моль ≈ 0,34 моль
5) Теперь находим молярную концентрацию хлорида аммония:
ответ: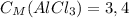 моль/л
моль/л