Алюміній масою 5,4 г прореагував із сульфатною кислотою. Маса отриманої солі становила 30,78 г. Обчисліть відносний вихід продукту реакції (у %).
Другие вопросы по теме Химия
Популярные вопросы
- 3267+(4078*8-8960/7)= найди значения выражений?...
2 - Петя сьел орешков в 2разаменьше чем коляи на 2 большечем валя. всего...
3 - Найдите значение выражения (4√7 + √23)^2 - 8√161...
3 - 1.какие свойства коацерватов,по мнению а.и.опарина,позволили считать...
3 - Лист бумаги согнули вдвое по прямой и прокололи только в двух местах,...
1 - Пушкин сказал об этом произведении о стихах я не говорю , половина...
1 - Просклонять по падежам фиалка ладыш стекло...
1 - Даром 20 ) напишите что хотите, жалобу не кину)...
2 - Скажи,на какой вопрос отвечает каждое выделенное слово и с каким...
2 - Обведи ноиер глагола й спрежнния люб шь хвал ть держ шь исполня...
2
Дано:
m(Al) = 5,4 г
H2SO4
m(практ. Al2(SO4)3) = 30,78 г
Знайти: W(Al2(SO4)3)-?
1)Знайдемо теоретично можливу масу алюміній сульфату. Для цього запишемо рівняння реакції і знайдемо цю масу , виходячи з рівняння.
5,4 г х г
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
2*27=54 г 342 г
m(теор. Al2(SO4)3) =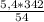 = 34,2 г
= 34,2 г
2)Знайдемо відносний вихід продукту за формулою:
W(Al2(SO4)3) = m(практ.)/m(теор.) *100% = 30,78 г / 34,2 г *100% = 90%
Відповідь: відносний вихід продукту 90%