1) сколько грамм хлорида цинка образуется при взаимодействии соляной кислоты с 30 г образца цинка содержащего 25% примесей 2)вычислите массу карбоната кальция, образовавшегося при пропускании 6 г углекислого газа через раствор гидроксида кальция в котором масса гидроксида кальция составляет 8 г (решать надо на избыток и недастаток) 3) сколько молекул будет содержать 22 г кислорода какой объём они будут занимать 4)
Другие вопросы по теме Химия
Популярные вопросы
- Почему амины предельного ряда-органические основания? ответ обоснуйте...
3 - 1)найдите критические точки функции: y=0,5sin2x-sinx 2)промежутки убывания...
1 - Волимпиаде по приняли участие 120 учащихся пятых и шестых классов. пятиклссники...
2 - Диалог на казахском языке про дружбу...
2 - Вычислить площадь прямоугольника , если его стороны равны 4 м и 1,5...
2 - На дровенном складе продали 1 день 17 процентов всех дров,во второй...
1 - Мотоциклист проехал до места назначения 370 км сделав одну остановку...
1 - 1).как представить в виде неправильной дроби число: 2 1/7 и 4; как выделить...
3 - Решающая на оценку хоккейная шайба, имеющая начальную скорость 5 м/с,...
1 - Прямоугольник,одна сторона которого на 2 см больше другой,имеет площадь,...
3
1)Zn+2HCl=ZnCl2+H2(улетучивается)
Масса чистого цинка=30-(30*0,25)=22,5г
Кол-во в-ва цинка=22,5/65=0,35 моль
Кол-во в-ва хлорида цинка=Кол-ву в-ва цинка=>
масса хлорида цинка=0,35* 136=47,6г
Ca(OH)2+CO2-->СаСО3+H2O
Кол-во в-ва СО2=6/44=0,136моль
Кол-во в-ва Ca(OH)2=8/74=0,108моль
Масса CaCO3=0,108*100=10,8г
Задача 1
w(Zn)=1-0,25=0,75
m(Zn)=m(смеси)*w(Zn)=30*0,75=22,5 грамм
n(Zn)=m/M=22,5/65=0,3 моль
Zn + 2HCl → ZnCl2 + H2
n(Zn)=n(ZnCl2)=0,3 моль
m(ZnCl2)=0,3*135=40,5 грамм
ответ: m(ZnCl2)=40,5 грамм
Задача 2
n(Ca(OH)2)=m/M=8/74=0,1 моль
CO2(недост.) + Ca(OH)2(изб.) → CaCO3↓ + H2O
n(Ca(OH)2)=n(CaCO3)=0,1 моль
m(CaCO3)=0,1*100=10 грамм
ответ: m(CaCO3)=10 грамм
Задача 3
Mr(O2)=Ar(O)*2=16*2=32
M(O2)=32 г/моль
n(O2)=m/M=22/32=0,7 моль
V(O2)=n*Vm=0,7*22,4=15,68 литров
No(O2)=n*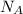 =0,7*6,02*
=0,7*6,02*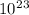 =4,214*
=4,214*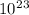 молекул
молекул
ответ: V(O2)=15,68 литров; No(O2)=4,214*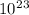 молекул
молекул