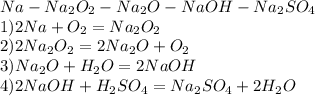1)опредилите массу осадка,образовавшегося в результате окисления 0,2 моль уксусного альдегида избытком аммиачного раствора оксида серебра. 2)вычислить массу и количество вещества оксида кальция,полученного при разложении 100грамм карбоната кальция,содержащего 2% примеси. 3)напиши уравнение реакции с которых можно осуществить следующие превращения: na⇒na₂o₂⇒na₂o⇒naoh⇒na₂so₄
Другие вопросы по теме Химия
Популярные вопросы
- Почему альвеолы состоят из 1 слоя эпителия? В чём биологический смысл?...
2 - Біология. 6 класс. Вариант БИ60102 9Ребята в школе провели следующий...
2 - Якою є основна тема твору? • Яке ідейне навантаження несе образ галерника?...
2 - Две конкурирующих кондитерских выпускают одинаковый по названию шоколад,...
3 - Які жанри характеризуючи розвиток Українськой поезії...
1 - Придумайте и запишите рассказ на тему школьной жизни, используя как...
1 - Ми дозволимо тілу масою m вільно падати з висоти h = 50 м (початкова...
3 - Open the brackets. 1. Which of your friends (not to like) to go to...
3 - Как сохранить дом, расположенный на краю оползня?...
1 - Сделайте плз Коллаж города...
2
1. Задачу смотри по ссылке(сколько можно ее
2.
98 г х моль
100 г 1 моль
1. Т.к. на чистый карбонат в образце приходится 98%,то определим его чистую массу:
100 г образца - это 100%, а
х г карбоната в нем - 98%, откуда х=98*100/100=98 г
2. Подставив эту массу в уравнение реакции,получим количество вещества оксида:
при разложении 100 г карбоната образуется 1 моль оксида, а
при --//--//-- 98 г___________________х моль, откуда х=98*1/100=0,98 моль
3. Умножив это количества вещества на молярную массу оксида кальция,получим массу его:
m(CaO)=v*M=0,98*56=54,88 г
3.