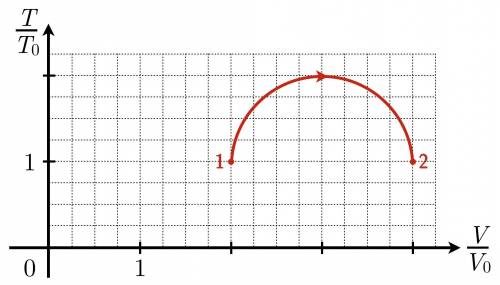
Температура и объём ν=0,1 моль идеального газа составляли T1=T0 и V1=2V0 соответственно. С этой порцией газа провели процесс 1–2, в ходе которого его температура T и объём V изменялись так, как показано на рисунке. В относительных координатах T/T0 и V/V0 график этого процесса представляет собой полуокружность. Какое наибольшее давление имел газ в этом процессе, если T0=325К и V0=1,5 л? ответ выразить в кПа, округлив до целых. Значение универсальной газовой постоянной принять равным R=8,31 Дж/(К*моль)
Другие вопросы по теме Физика
Популярные вопросы
- Розв яжіть систему рівнянь методом додавання :...
1 - Окно не пропускало свет определить падеж окно...
1 - 0 Упражнение 383. Спишите загадки, вставляя пропущенные буквы. Запишите...
3 - решить 3, если можно то и 4 и 5)...
1 - 2 2/3 × х-1 5/7= 3 1/21 решите уравнение ...
1 - Регіон тихого океану де розташовані гавайські острови А ПолінезіяБ МеланезіяВ...
2 - Докладниі усний переказ тексту публіцистичного стилю з елементами роздуму(за...
1 - 3. Установіть відповідність між типами зв язку і складним реченням. 1...
2 - Можете сделать 20 б, химия 9 класс,...
2 - Русалочка-то и смеяться перестала, да вдруг как заплачет... Почему русалочка...
3
135 кПа
Объяснение:
Запишем уравнение Менделеева-Клапейрона:
Зависимость температуры от объема:
Хорошо видно, что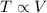 для разных постоянных p. Таким образом, угол наклона изобары в TV координатах полностью определяется значением давления. Найдем ту прямую, которая будет иметь наибольший возможный угол наклона к оси V. Очевидно это прямая ОА, являющаяся касательной к графику процесса. Треугольники ОАВ и ВСО равны, тангенс угла ВОС:
для разных постоянных p. Таким образом, угол наклона изобары в TV координатах полностью определяется значением давления. Найдем ту прямую, которая будет иметь наибольший возможный угол наклона к оси V. Очевидно это прямая ОА, являющаяся касательной к графику процесса. Треугольники ОАВ и ВСО равны, тангенс угла ВОС:
Угол АОС:
Тангенс этого угла:
С другой стороны, тот же тангенс:
Откуда:
Запишем уравнение Менделеева-Клапейрона еще раз, но уже для максимального давления:
Откуда, максимальное давление: