Найти начальную температуру газа при давлении 5,1*10^5 па и объеме 4,1 м^3, если после нагрева газа до 203 c его объем и давление стали соответственно равны 2,6 м^3 и 10,2*10^5 па
Другие вопросы по теме Физика
Популярные вопросы
- нужно сравнить Европейскую часть и Азиатскую...
2 - Такырып:Монро доктринасы1. АҚШ-тағы «Айқын болашақ» идеясының мақсаты...
1 - Книга содержит 147 страниц. На каждой странице 38 строк. В каждой...
3 - 3. Бағбан ұзындығы 4 м және ені 2 м болатын жер телімін тормен...
1 - Менің атым тәуелсіздік идея мен тақырып! Отиниш керек! ...
3 - Какие фоты мазмножения существуют у растений...
2 - 1.Знайдіть усі кути трикутника, якщо а) один із них менший за другий...
3 - Это нужно писать по отдельности например 4 х отдельно х 10 поняли?...
2 - Забирайте балы мне не жалко...
1 - 1. В каком предложении на месте пропуска ставится запятая? 1)Из...
2
375,3 К или 102,3 оС
Объяснение:
Уравнение состояния идеального газа - это уравнение Менделеева-Клапейрона PV=vRT.
По условию дано два состояния
P1*V1=v*R*T1 (1)
P2*V2=v*R*T2 (2)
Выразим из первого ур-я начальную (неизвестную) температуру
T1=/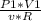 (3)
(3)
Заметим, что произведение количества вещества на газовую постоянную v*R будет одинаковым и в первом и во втором уравнении.
выразим из второго уравнения это произведение
v*R=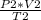 .
.
Подставим в v*R (3).
Окончательная формула
T1=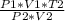 =
=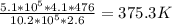
ответ: 375,3 К или (375,3-273) 102,3 град. Цельсия