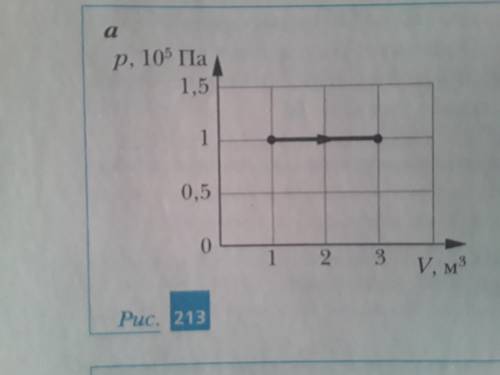
На рис. 213 показаны процессы изменения состояния одного моля идеального одноатомного газа. Рассчитайте количество теплоты
Другие вопросы по теме Физика
Популярные вопросы
- синтаксический разбор предложения: сколько красивых стихов и песен сложили люди...
1 - Сравните однодольные и двудольные растения по следующим признакам: расположение...
1 - Семья из трёх человек проживает в трёхкомнатной квартире площадью 60 м². рассчитайте...
3 - Летали девушки на тихоходных учебных самолетах конструкции по- 2, которых называли...
1 - :сочинение на тему если бы я была суперполицейской?...
1 - При каких значениях a система уравнений: y = ax, y = -3x+2 1 ) не имеет решений...
3 - 5/12(4,8p-4 4/5k)-4,6(4/9p-0,4k) решить...
3 - Напишите мини сочинение на тему: как я ходила в музей вов в городе казань...
1 - Самое интресное расстение из семейства разоцветных...
3 - Прочитайте предложения, исправьте речевые ошибки, запишите. 1. художник васильев...
1
ΔU = Q + W
где ΔU - изменение внутренней энергии системы, Q - количество теплоты, W - работа.
Первым делом, необходимо охарактеризовать каждый из процессов на рисунке.
1. AB: изохорный процесс или процесс при постоянном объеме. В данном случае объем газа не меняется, а значит, совершаемая работа W = 0.
2. BC: адиабатический процесс (без теплообмена с окружающей средой). Также, данные процессы являются поворотами находящиеся графики процессов с перпендикулярным углом к оси температуры. Из графика можно сделать вывод, что данный процесс является адиабатическим, следовательно Q = 0.
3. CD: изобарный процесс или процесс при постоянном давлении. Здесь график представляет собой прямую линию (параллельную оси температуры), что указывает на то, что давление газа не меняется во время этого процесса.
4. AD: политропный процесс. В данном случае, график задан кривой, что указывает на наличие как теплообмена, так и работы (работа ≠ 0), однако конкретные значения работы и теплоты нам неизвестны.
Теперь мы можем использовать первое начало термодинамики для каждого процесса:
1. Для процесса AB, где W = 0, уравнение первого начала термодинамики примет вид:
ΔU = Q + 0,
∆U = Q.
2. Для процесса BC, где Q = 0, уравнение первого начала термодинамики примет вид:
∆U = 0 + W,
W = ∆U.
3. Для процесса CD, где процесс происходит при постоянном давлении, мы можем использовать второй закон термодинамики. Это позволит нам связать теплоту с изменением объема:
Q = P * ΔV.
4. Для процесса AD, где газ подвергается изменению в давлении и объеме, мы не знаем конкретные значения работы и теплоты. Поэтому, они могут быть вычислены только при заданном уравнении состояния газа или дополнительной информации о системе.
В итоге, для данной системы, мы можем рассчитать количество теплоты только для процесса CD, используя уравнение Q = P * ∆V, где P - постоянное давление газа, а ∆V - изменение объема газа в процессе CD. Однако, без дополнительной информации, мы не можем рассчитать конкретное количество теплоты для данной системы.