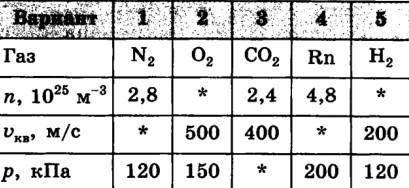
Газ при средней квадратичной скорости движения молекул vкв и концентрации n производит давление p на стенки . Тип газа указан в таблице. Определите значение величины, обозначенной *
Другие вопросы по теме Физика
Популярные вопросы
- Деление обыкновенных дробей и смешанных чисел. Урок 1Вычисли....
3 - Ребят очень надо соч таблица тут...
2 - 3.Берілген тұжырымдардан бір «жалған» ақпаратты анықтаңыз. №Мәтіндегі...
3 - [2] 10. Сушу и океан связывают реки, впадающие в моря и несущие различныезагрязнители....
3 - Яка з даних фігур має центр семетрії? Трикутник, трапеція, відрізок,...
2 - Найди высоту прямоугольного 3параллелепипеда, если объем равен 21451см,...
3 - Task 3. Answer for these questions 1. What were you doing yesterday...
2 - Кабыргасыннын калындыгы 1см, кырынын узындыгы 7см, иши куыс мыс кубтын...
2 - 5. Найдите периметр прямоугольника со сторонами3 1/2 м и 2 м.у меня...
1 - сделать буклет на тему: «Социально-психологические факторы, определяющие...
1
Из задачи нам дана таблица с четырьмя типами газов, каждый из которых имеет свою среднюю квадратичную скорость движения молекул (vкв), концентрацию (n) и давление на стенки (p).
Давайте посмотрим на каждый тип газа по отдельности.
1. Гелий (He)
- Средняя квадратичная скорость движения молекул (vкв) равна 1100 м/с.
- Концентрация (n) равна 2,5 * 10^25 молекул/м^3.
- Давление на стенки (p) обозначено как p1.
2. Водород (H2)
- Средняя квадратичная скорость движения молекул (vкв) равна 1800 м/с.
- Концентрация (n) равна 3,0 * 10^25 молекул/м^3.
- Давление на стенки (p) обозначено как p2.
3. Кислород (O2)
- Средняя квадратичная скорость движения молекул (vкв) равна 1300 м/с.
- Концентрация (n) равна 2,2 * 10^25 молекул/м^3.
- Давление на стенки (p) обозначено как p3.
4. Углекислый газ (CO2)
- Средняя квадратичная скорость движения молекул (vкв) равна 900 м/с.
- Концентрация (n) равна 2,8 * 10^25 молекул/м^3.
- Давление на стенки (p) обозначено как p4.
Теперь задача заключается в определении значения величины, обозначенной как * в таблице.
Для определения этой величины мы можем использовать уравнение состояния идеального газа:
pV = nRT,
где p - давление на стенки, V - объем газа, n - концентрация газа (число молекул в единице объема), R - универсальная газовая постоянная, T - температура газа.
В данной задаче известны только p и n, поэтому давайте исключим из уравнения объем и температуру.
Так как у нас есть несколько типов газов, можно предположить, что давление пропорционально концентрации:
p1/n1 = p2/n2 = p3/n3 = p4/n4.
Используя это соотношение, можно записать выражение для величины *, которую нам нужно определить:
p/n = *.
Теперь осталось только подставить значения из таблицы и выполнить расчеты.
Для гелия (He):
p1/n1 = *
Для водорода (H2):
p2/n2 = *
Для кислорода (O2):
p3/n3 = *
Для углекислого газа (CO2):
p4/n4 = *
Произведите расчеты и найдите значения величины *, обозначенной в задаче.