Внаходится газ при температуре 27℃ и давлении 3 × 10 ⁵ па. после того как ⅓ газа выпустили из ,давление в нем стало равным 1,8 × 10 ⁵па. определите,какая температура установится в .
Другие вопросы по теме Алгебра
Популярные вопросы
- Написать сочинение или эссе на тему учитель-великое имя . объем...
3 - (5-х)(х+4)=0 можете подробно написать, типо я решала другим но...
2 - Создать букву в и с в html,кто занимается программированиемсоздала...
3 - Былкылдак куйынын шыгу тарихы...
1 - 3. американский социолог р. мертон ввёл в науку понят «ролевой...
1 - Определить по морфологические приднодлежность данных растений к...
2 - 1. найдите длину вектора cd, концы которого имеют координатыc(-3;...
3 - выписать из художественной 5 предложений со средствами художественной...
2 - Назвіть кістки грудної клітини: а - грудина б - лопаткав - ребраг...
2 - Вычисли ,меняя множители местами и объединяя их в группы : 2 •9•5=9•...
3
Дано: t₁ = 27°C; P₁=3·10⁵ Па; P₂=1,8·10⁵ Па;
Найти: t₂ - ?
Температура по шкале Кельвина T₁=t₁+273° = 27°+273°=300K
Уравнение Менделеева-Клапейрона для начального состояния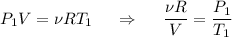
Треть газа выпустили, осталось 2/3 количества вещества.
Уравниваем :
t₂ = 270 K - 273° = -3°C
ответ : -3°C